Comme les plantes et les algues, les cyanobactéries
(voir encadré), utilisent la lumière comme source d’énergie. Cependant,
un excès de lumière peut être mortel pour ces organismes
photosynthétiques du fait de la production de dérivés réactifs de
l’oxygène tels que les radicaux libres. Pour se protéger d’un tel
phénomène, les cyanobactéries convertissent une partie de l’énergie
qu’elles collectent sous forme de chaleur. Cette photoprotection met en
jeu un mécanisme moléculaire découvert récemment et dont l’élément clé
est une protéine soluble photoactive : l’Orange Carotenoid Protein
(OCP). En savoir plus sur les cyanobactéries
Apparues il y a environ 2,5 - 3 milliards d'années, les cyanobactéries sont à l’origine de la présence d’oxygène dans l’atmosphère : c’est par photosynthèse qu’elles ont produit ce gaz si nécessaire à l’expansion des formes de vie actuelles sur Terre. Elles jouent également un rôle majeur dans le fonctionnement des écosystèmes grâce à leur aptitude à fixer le carbone et l’azote atmosphériques.Présentes dans les eaux douces ou salées, à la surface des sols, dans les zones froides ou chaudes, ces bactéries sont aussi des organismes pionniers des milieux désertiques et autres environnements extrêmes. Connues pour proliférer de façon parfois importante, les cyanobactéries peuvent alors être à l’origine de nombreux problèmes parmi lesquels la production de toxines potentiellement dangereuses pour l’homme et l’animal.Celle-ci contient un caroténoïde qui est un pigment (c’est-à-dire une molécule capable
d’absorber
la lumière). En combinant des techniques sophistiquées de chimie des
protéines et de génétique, une équipe internationale impliquant l’Inra,
le CEA et le CNRS a élucidé la structure tridimensionnelle de la forme
active de la protéine OCP. Pour la première fois, les chercheurs
révèlent comment, en absorbant la lumière, le caroténoïde effectue un
changement de position et de
conformation important. En effet, le
pigment se déplace de douze angströms (soit douze fois un dixième de
milliardième de mètre) à l’intérieur de la protéine OCP et il passe
d’une forme orange inactive à une forme rouge active. C’est ce mouvement
qui entraîne un changement de conformation de la protéine OCP et permet
de protéger les cellules des stress oxydatifs.Ces travaux permettent
d’affiner les connaissances des mécanismes de transfert d’énergie et de
photoprotection chez les cyanobactéries. Ils ouvrent la voie à une
utilisation optimisée de ces organismes pour la production de biomasse ou de composés biosourcés d’intérêt industriel. Ils
permettent également d’envisager le développement de nouveaux systèmes
de production d'énergie utilisant la lumière solaire. De plus,
l’utilisation de l’OCP est prometteuse en optogénétique (contrôle par la lumière d’enzymes et activités cellulaires ciblées) avec des applications dans la biologie de synthèse et les études in situ.
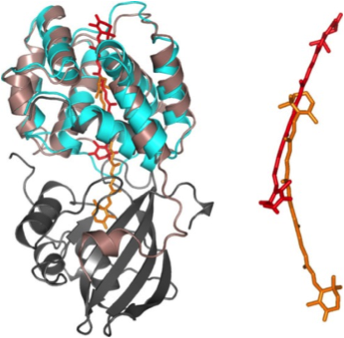
Représentation tridimensionnelle de la protéine OCP (Orange Carotenoid Protein), dans sa forme inactive (gris) et sa forme active (bleu ciel) avec en son centre le caroténoïde (orange ou rouge). En se déplaçant de douze angströms à l’intérieur de l’OCP, le caroténoïde (d’abord sous forme orange) arbore une forme plus plane et crée de nouvelles interactions avec les acides aminés de la protéine OCP (forme rouge du pigment). Les domaines C et N terminaux de la protéine OCP, jusque-là réunis par le caroténoïde, se séparent, faisant alors évoluer la protéine OCP vers une conformation ouverte. Les scientifiques ont montré que la protéine OCP s’attache ensuite par un de ses côtés au phycobilisome (c’est-à-dire l’antenne cyanobactérienne) et induit la dissipation thermique de l’excès d’énergie absorbée. © Diana Kirilovsky