Les bactéries sont des organismes unicellulaires délimités par une paroi rigide qui maintient leur forme et leur intégrité. Les polymères qui la composent ainsi que leur mode d'association varient selon les espèces bactériennes. Toutefois, le peptidoglycane, un composant spécifique de ces organismes, constitue la base de la paroi bactérienne, quelle que soit l'espèce rencontrée. De manière générale, un grand nombre d'antibiotiques ont pour mode d'action de bloquer la synthèse du peptidoglycane afin d'empêcher la bactérie de se développer, et ainsi la neutraliser.
Mais depuis plusieurs années, les bactéries ont développé une résistance aux antibiotiques qui rendent ces derniers de moins en moins efficaces. Pour lutter contre cette résistance, les chercheurs ont tout d'abord étudié les mécanismes de synthèse des parois bactériennes. Néanmoins, ils font face à un défi important : les méthodes classiques de biologie structurale (diffraction des rayons X, RMN en solution, microscopie) ne permettent pas d'étudier la paroi bactérienne dans son ensemble et avec toute sa complexité.
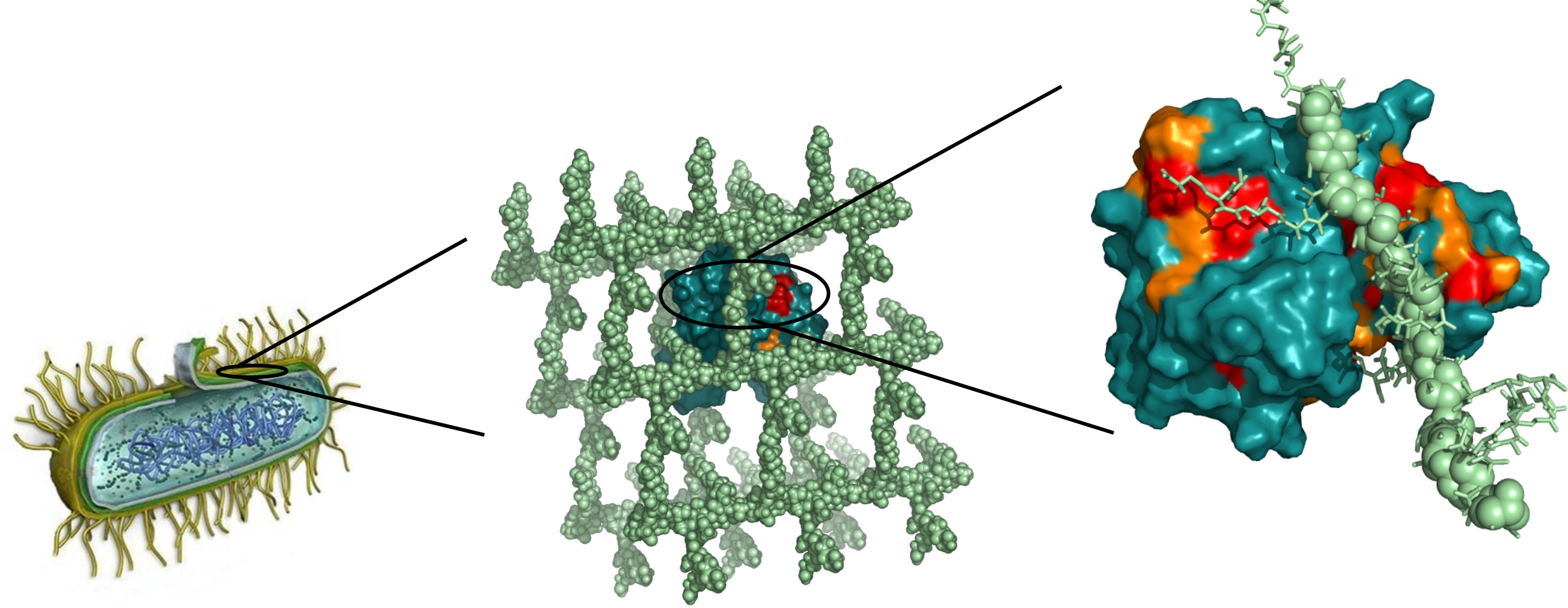
Des chercheurs de l'Institut de biologie structurale (IBS-CEA/CNRS/Université Joseph Fourier) ont réussi à surmonter cet obstacle technique en utilisant une nouvelle méthode d'analyse basée sur la « spectroscopie RMN du solide ». A l'aide de cette dernière, ils ont pour la première fois décrit avec précision les mécanismes de synthèse d'une paroi bactérienne. Ils ont mis en évidence les interactions existantes entre le peptidoglycane et la L,D-transpeptidase, enzyme responsable du « maillage » de ce dernier en un réseau rigide. La description de ces interactions pourrait conduire à la mise au point d'antibiotiques qui, en ciblant les enzymes de fabrication de la paroi bactérienne, en bloqueraient la synthèse. Ces travaux sont donc déterminants pour la conception de nouvelles molécules antibiotiques contournant les résistances actuelles.
Basée sur la « résonance magnétique nucléaire » (RMN),
la spectroscopie est une technique qui exploite les propriétés
magnétiques de certains noyaux atomiques. La « RMN à l'état liquide »
est une méthode bien établie, permettant l'étude des molécules en
solution, tandis que la « RMN à l'état solide », méthode plus récente,
permet d'étudier des protéines dans un état solide telles que les fibres
amyloïdes ou les protéines membranaires.
Légende : Les détails moléculaires des interactions entre la paroi bactérienne et ses enzymes de fabrication ont pu être explorés par les techniques récentes de RMN du solide. (© IBS)